 PDF(14543 KB)
PDF(14543 KB)


内脏钙化防御合并重度铁过载一例
邢婕, 张晓良, 谢筱彤, 杨璨粼, 刘宏, 刘玉秋
 PDF(14543 KB)
PDF(14543 KB)
内脏钙化防御合并重度铁过载一例
A case of visceral calcification combined with severe iron overload
48岁男性患者,维持性血液透析11年,继发性甲状旁腺功能亢进6年,6个月前接受甲状旁腺切除术及右前臂甲状旁腺自体移植术。不明原因反复腹痛腹泻1年,伴消瘦,颜面部、手背部皮肤呈古铜色。结合实验室及影像学检查诊断为内脏钙化防御(累及肺、肠)及重度铁过载(累及皮肤、肝、脾)。予以硫代硫酸钠为主的综合治疗,腹痛腹泻症状改善。
肾透析 / 血管钙化 / 内脏钙化防御 / 铁过载 {{custom_keyword}} /
孙玉玲 , {{custom_editor}}
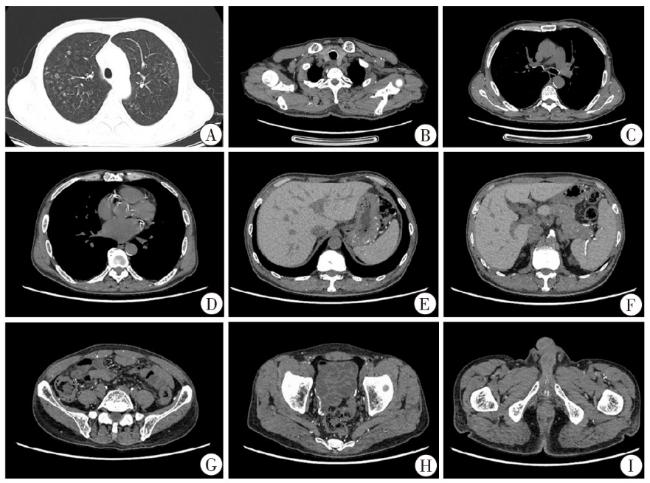
图3 患者胸腹盆部各级小动脉多处钙化灶(CT平扫)注:A:两肺见散在结节及片絮状影,部分钙化,呈“雪花点”样改变;B:气管管壁环状钙化,皮下软组织及肌肉间隙见多发散在钙化点;C:支气管管壁钙化,皮下软组织及肌肉间隙见多发散在钙化点;D:冠脉走行区见钙化影;E:胃体见散在血管钙化影;F:脾动脉见条状血管钙化影;G:肠系膜动脉所属分支见多发散在血管钙化影;H:肠道见迂曲血管钙化影;I:阴茎动脉钙化,肌肉间隙见散在钙化影 |
表1 患者治疗前后实验室检查结果 |
| 项目 | 2019-7-12 | 2019-8-23 |
|---|---|---|
| 血清钙(mmol/L) | 1.52 | 1.54 |
| 血清磷(mmol/L) | 0.72 | 1.10 |
| 血白蛋白(g/L) | 33.4 | 40.4 |
| 血清铁蛋白(μg/L) | 2 306 | 1 857 |
| 转铁蛋白饱和度(%) | 77.8 | 76.5 |
| [1] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [2] |
刘玉秋, 杨璨粼, 汤日宁, 等. 《钙性尿毒症性小动脉病》后续报道[J]. 肾脏病与透析肾移植杂志, 2019, 28(3): 291-292. DOI: 10.3969/j.issn.1006-298X.2019.03.020.
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [3] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [4] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [5] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [6] |
A 19-year-old woman, with normal kidney function, was diagnosed as having visceral calciphylaxis, especially diffuse breast and lung calcification. The calcification findings were clearly shown on CT, and bone scintigraphy revealed diffuse uptake in the thoracic area. Although there was no standard therapeutic approach for this clinical setting, the patient received empiric therapy with sodium thiosulfate. After 5 months of consecutive therapy, the calcification condition had a striking regression.
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [7] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [8] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [9] |
刘玉秋, 张晓良, 汤日宁, 等. 钙性尿毒症性小动脉病[J]. 肾脏病与透析肾移植杂志, 2018, 27(3): 294-299. DOI: 10.3969/j.issn.1006-298X.2018.03.021.
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [10] |
The Japanese Society for Dialysis Therapy (JSDT) guideline committee, chaired by Dr Y. Tsubakihara, presents the Japanese guidelines entitled “Guidelines for Renal Anemia in Chronic Kidney Disease.” These guidelines replace the “2004 JSDT Guidelines for Renal Anemia in Chronic Hemodialysis Patients,” and contain new, additional guidelines for peritoneal dialysis (PD), non‐dialysis (ND), and pediatric chronic kidney disease (CKD) patients.
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [11] |
Before the introduction of erythropoiesis-stimulating agents (ESAs) in 1989, repeated transfusions given to patients with end-stage renal disease caused iron overload, and the need for supplemental iron was rare. However, with the widespread introduction of ESAs, it was recognized that supplemental iron was necessary to optimize hemoglobin response and allow reduction of the ESA dose for economic reasons and recent concerns about ESA safety. Iron supplementation was also found to be more efficacious via intravenous compared to oral administration, and the use of intravenous iron has escalated in recent years. The safety of various iron compounds has been of theoretical concern due to their potential to induce iron overload, oxidative stress, hypersensitivity reactions, and a permissive environment for infectious processes. Therefore, an expert group was convened to assess the benefits and risks of parenteral iron, and to provide strategies for its optimal use while mitigating the risk for acute reactions and other adverse effects.Copyright © 2016 International Society of Nephrology. Published by Elsevier Inc. All rights reserved.
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [12] |
A molt, conducive to the loss and subsequent replacement of all cutaneous layers, can be induced by topical "calciphylaxis" in the rat. This is accomplished by sensitization with dihydrotachysterol followed by challenge with egg white or ferric dextran.
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [13] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [14] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| {{custom_ref.label}} |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
所有作者均声明不存在利益冲突
 PDF(14543 KB)
PDF(14543 KB)
文章所在专题
/
| 〈 |
|
〉 |