
本刊微信公众号
“CONSORT(Consohdated Standards of Reporting Trials)声明”,是国际上一个由临床流行病学家、临床专业人员、统计学家和医学杂志编辑组成的课题组制作的一个随机对照临床试验报告的规范,并在医学杂志上应用。应用规范的实践结果表明,临床试验报告的质量有了很大提高。
“CONSORT声明”包括一张含有25条基本要素的对照检查清单(表1)和一张流程图(图1),可供临床试验研究者、杂志编辑和审稿专家对一篇随机对照试验进行核对,并督促作者按照该规范的要求撰写随机对照临床试验报告。此外,临床研究者还可根据该规范的各项条目严格设计一项随机对照临床试验,但需注意的是,“CONSORT声明”不包含任何对试验设计、实施和结果分析的建议,仅仅是说明如何报告已完成的工作和获得的结果。此声明可为报告各种随机对照临床试验提供指导,但主要针对最常用的设计类型,即两组平行随机对照试验。其他试验类型,诸如群组随机临床试验和非劣效性临床试验,需要或多或少的增加一些信息,具体可参考各种CONSORT扩展版及其他相关资料(www.consort-statement.org)。
表1 随机临床试验应报告信息的对照检查清单(CONSORT 2010)
|
论文章节/主题 |
条目号 |
对照检查的条目 |
报告页码 |
|
文题和摘要 |
|||
|
|
|
文题中能识别是随机临床试验 |
|
|
1b |
结构式摘要,包括试验设计、方法、结果、结论几个部分 |
|
|
|
引言 |
|||
|
背景和目的 |
|
科学背景和对试验理由的解释 |
|
|
2b |
具体目的和假设 |
|
|
|
方法 |
|||
|
试验设计 |
|
描述试验设计(诸如平行设计、析因设计),包括受试者分配入各组的比例 |
|
|
3b |
试验开始后对试验方法所作的重要改变(如合格受试者的挑选标准),并说明原因 |
|
|
|
受试者 |
|
受试者合格标准 |
|
|
4b |
资料收集的场所和地点 |
|
|
|
干预措施 |
5 |
详细描述各组干预措施的细节以使他人能够重复,包括它们实际上是在何时、如何实施的 |
|
|
结局指标 |
|
完整而确切地说明预先设定的主要和次要结局指标,包括它们是在何时、如何测评的 |
|
|
6b |
试验开始后对结局指标是否有任何更改,并说明原因 |
|
|
|
样本量 |
|
如何确定样本量 |
|
|
7b |
必要时,解释中期分析和试验中止原则 |
|
|
|
随机方法: |
|
|
|
|
序列的产生 |
|
产生随机分配序列的方法 |
|
|
8b |
随机方法的类型,任何限定的细节(如怎样分区组和各区组样本多少) |
|
|
|
分配隐藏机制 |
9 |
用于执行随机分配序列的机制(例如按序编码的封藏法),描述干预措施分配之前为隐藏序列号所采取的步骤 |
|
|
实施 |
10 |
谁产生随机分配序列,谁招募受试者,谁给受试者分配干预措施 |
|
|
盲法 |
|
如果实施了盲法,分配干预措施之后对谁设盲(例如受试者、医护提供者、结局评估者),以及盲法是如何实施的 |
|
|
11b |
如有必要,描述干预措施的相似之处 |
|
|
|
统计学方法 |
|
用于比较各组主要和次要结局指标的统计学方法 |
|
|
12b |
附加分析的方法,诸如亚组分析和校正分析 |
|
|
|
结果 |
|||
|
受试者流程(极力推荐使用流程图) |
|
随机分配到各组的受试者例数,接受已分配治疗的例数,以及纳入主要结局分析的例数 |
|
|
13b |
随机分组后,各组脱落和被剔除的例数,并说明原因 |
|
|
|
招募受试者 |
|
招募期和随访时间的长短,并说明具体日期 |
|
|
14b |
为什么试验中断或停止 |
|
|
|
基线资料 |
15 |
用一张表格列出每一组受试者的基线数据,包括人口学资料和临床特征 |
|
|
纳入分析的例数 |
16 |
各组纳入每一种分析的受试者数目(分母),以及是否按最初的分组分析 |
|
|
结局和估计值 |
|
各组每一项主要和次要结局指标的结果,效应估计值及其精确性(如95%可信区间) |
|
|
17b |
对于二分类结局,建议同时提供相对效应值和绝对效应值 |
|
|
|
辅助分析 |
18 |
所做的其他分析的结果,包括亚组分析和校正分析,指出哪些是预先设定的分析,哪些是新尝试的分析 |
|
|
危害 |
19 |
各组出现的所有严重危害或意外效果 |
|
|
讨论 |
|||
|
局限性 |
20 |
试验的局限性,报告潜在偏倚和不精确的原因,以及出现多种分析结果的原因(如果有这种情况的话) |
|
|
可推广性 |
21 |
试验结果被推广的可能性(外部可靠性,实用性) |
|
|
解释 |
22 |
与结果相对应的解释,权衡试验结果的利弊,并且考虑其他相关证据 |
|
|
其他信息 |
|
||
|
试验注册 |
23 |
临床试验注册号和注册机构名称 |
|
|
试验方案 |
24 |
如果有的话,在哪里可以获取完整的试验方案 |
|
|
资助 |
25 |
资助和其他支持(如提供药品)的来源,提供资助者所起的作用 |
|
与本清单有关的各种扩展版及最新参考资料,见www.consort-statement.org
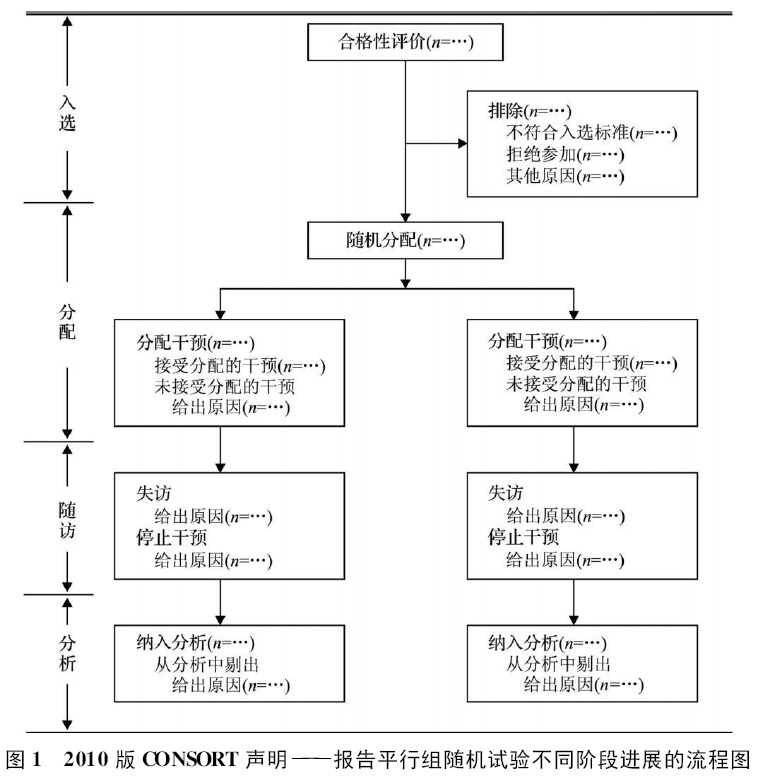
本刊将采用此声明所包含的要素及流程审查随机对照临床试验类稿件,因此来稿请按此声明的要求完善随机对照临床试验报告。此外,临床试验研究的摘要应尽可能含有CONSORT 2010年声明(Consdidated Standards of Reporting Trials)(http://www.consort-statement.org/home)列出的基本要素。特别需要提醒的是,随机对照临床试验类论文还需要标注临床试验注册号。临床试验注册号应是从WHO认证的一级临床试验注册中心获得的全球唯一的注册号。临床试验注册号标注在摘要结束处。以“临床试验注册(Trial registration)”为标题,写出注册机构名称和注册号。
《中华肾脏病杂志》编辑部